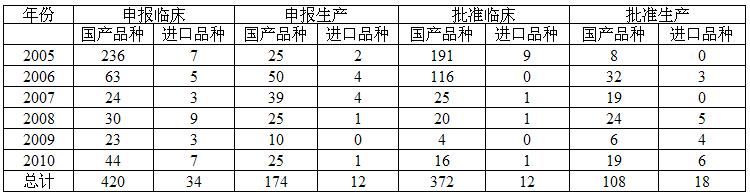
| 我国他汀类药物申报现状与分析 |
他汀类药物(statins),即3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methyglutaryl-coenzyme,HMG-CoA)还原酶抑制剂。大量基础研究和临床试验显示,他汀类药物不仅具有强大的降脂作用,还具有独立于其降脂作用之外的“多重效应”[1-3],如:改善血管内皮功能、抑制炎症和抗氧化反应、抗血小板聚集和抑制血栓形成、稳定粥样硬化斑块、抑制心肌细胞重塑和心肌细胞凋亡、抑制心脏电生理重塑和调节心脏植物神经功能等一系列作用。4S研究、CARE研究、LIPID研究等大规模临床试验结果显示,一些他汀类药物在迅速降低异常高的血浆总胆固醇(TC)水平的同时,可显著降低冠心病发病率、死亡率、降低总死亡率,在冠心病的一级预防和二级预防中发挥了重要作用,因此,他汀类药物的出现是心血管疾病治疗史上一个重要的里程碑[4],并成为目前临床上用于治疗各类高脂血症、防治动脉粥样硬化及冠心病的主力血脂调节药物,也是全球医药市场著名的“重磅炸弹”级药物。
参考文献:
1.Wang CY, Liu PY, Liao JK. Pleiotropic effects of statins therapy: molecular mechanism and clinical results[J]. Trends Mol Med, 2008,14(1):37-44. 2.Lertsburapa K, White CM, Kluger J, et al. Preoperative statins for the prevention of atrial fibrillation after cardiothoracic surgery[J]. J Thorac Cardiovasc Surg, 2008,135(2):405-411. 3.Liu PY, Liu YW, Lin LJ, et al. Evidence for statin pleiotropy in humans: differential effects of statins and ezetimibe on rhoassoicated coiled-coil containing protein kinase activity, endothelial function, and inflammation[J].Circulation, 2009,119(1):131-138. 4.Milionis HJ, Liberopoulos EN, Achmastos A, et al. Statins another class of antihypertensive agents?[J]. J Hum Hypertens 2006, 20(5):320-335. 5.杨志敏,杨进波,冯毅。促进我国创新药研发关键技术要素的探讨。中国新药杂志 2010,19(7):558-560. 6.EMEA: Guideline on Clinical Development of fixed combination of Medicinal Products[EB/OL]. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003686.pdf, 2009-2-19. (来源:CED,谢松梅、王涛、华尉利) |