| 左乙拉西坦注射液、口服液、缓释片 |
左乙拉西坦注射液+口服液+缓释片
1. 产品信息
通用名称:左乙拉西坦
英文名:Levetiracetam
化学名:(S)-α-乙基-2-氧代-1-吡咯烷乙酰胺
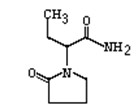 分子式 :C8H14N2O2
分子量 :170.21
适应症:用于成人及4岁以上儿童癫痫患者部分性发作的加用治疗。
用法用量:成人和青少年(12-17岁)(体重≥50 kg者):起始治疗剂量为每次500 mg,每日2次。根据临床效果及耐受性,每日剂量可增加至每次1500 mg,每日2次。剂量的变化应每2-4周增加或减少500 mg/次,每日2次。老年人:根据肾功能状况,调整剂量。4-11岁的儿童和青少年(12-17岁)(体重≤50 kg者) :起始治疗剂量是10 mg/kg,每日2次。根据临床效果及耐受性,剂量可以增加至30 mg/kg,每日2次。 剂量变化应以每2周增加或减少10 mg/kg,每日2次。
是否医保:属于医保乙类(口服常释剂型),编号522
2. 注册类型
原料:化药3类
注射液:化药3类(规格:500mg:5ml)
口服溶液:化药6类(规格:10%)
片剂:化药6类(规格:0.25g;0.5g;1.0g)
3. 药理作用及作用机制
左乙拉西坦是一种吡咯烷酮衍生物,其化学结构与现有的抗癫痫药物无相关性。左乙拉西坦抗癫痫作用的确切机制尚不清楚。在多种癫痫动物模型中评估了左乙拉西坦的抗癫痫作用。左乙拉西坦对电流或多种致惊剂最大刺激诱导的单纯癫痫发作无抑制作用,并在其最大刺激和阈值试验中仅显示微弱活性。但对毛果芸香碱和红藻氨酸诱导的局灶性发作继发的全身性发作观察到保护作用,这两种化学致惊厥剂能模仿一些人伴有继发性全身发作的复杂部分性发作的特性。左乙拉西坦对复杂部分性发作的大鼠点燃模型的点燃过程和点燃状态均具有抑制作用。这些动物模型对人体特定类型癫痫的预测价值尚不明确。体外、体内试验显示,左乙拉西坦抑制海马癫痫样突发放电,而对正常神经元兴奋性无影响,提示左乙拉西坦可能选择性地抑制癫痫样突发放电的超同步性和癫痫发作的传播。左乙拉西坦在浓度高至10 uM时,对多种已知受体无亲和力,如苯二氮类、GABA、甘氨酸、NMDA、再摄取位点和第二信使系统。体外试验显示左乙拉西坦对神经元电压门控的钠离子通道或T-型钙电流无影响。左乙拉西坦并不直接易化GABA能神经传递,但研究显示对培养的神经元GABA和甘氨酸门控电流负调节子活性有对抗作用。在大鼠脑组织中发现了左乙拉西坦的可饱和的和立体选择性的神经元结合位点,但该结合位点鉴定和功能目前尚不明确。
4. 项目优势
1)无发作是抗癫痫药物治疗的主要目标,实现无发作能降低癫痫患者死亡率,提高就业率,改善生活质量。开浦兰中国注册临床试验结果显示,开浦兰用于成人及16岁以上青少年癫痫部分性发作的附加治疗,16周内,开浦兰组10.8%的患者无发作(安慰剂组仅有2%),发作频率降低≥50%的患者达55.9%,中度以上改善者达61%。开浦兰组不良反应发生率与安慰剂组相似,未发生严重不良事件。
2)癫痫治疗要持续数年,故应选择耐受性最好、对生活质量负面影响最小的药物。近年来抗癫痫药疗效增加,但仍有20%~30%的患者发作难以控制或出现明显不良反应。研究证实,左乙拉西坦安全性好,不良反应少,多为轻中度,主要发生在治疗前4周内,导致减量或撤药的绝对比例很低。长期治疗无肝、肾、血液及生化异常,不会产生耐药性,对认知功能无不良影响。3年治疗保留率高达58%。在儿童中,开浦兰的安全性与安慰剂相似。未充分控制的部分性癫痫患儿(4~16岁)使用开浦兰作为辅助治疗,耐受性良好。
3)左乙拉西坦具有全新作用机制,其结合位点是突触囊泡蛋白SV2A。药代动力学接近理想,口服吸收迅速,不受食物影响,生物利用度接近100%,蛋白结合率<10%,没有药物间相互作用,动力学特点呈线性。
4)起效迅速,起始剂量即为有效剂量(1000 mg/d),不经肝脏P450酶代谢(清除途径主要为肾脏)。虽然血浆半衰期为6~8小时(成人),由于与SV2A结合时间长,可每日2次用药。已有大量临床研究证实开浦兰的疗效。欧美注册试验中,开浦兰1000 mg治疗后第1天达到无发作的患者较基线时增加15%,难治性部分性癫痫无发作率达8.6%,发作频率降低≥50%的患者比例达41.3%。Ⅳ期临床研究中无发作率达20%,发作频率降低≥50%的患者比例达57.9%。
5. 国内首家产品信息
口服溶液:生产厂商:NextPharma SAS(法国)
商品名:开浦兰(英文商品名:Keppra)
国内批准上市时间:2012-06-07
公司名称:UCB Pharma S.A.(比利时)
注册证号:H20120224(规格:10%)
片剂: 生产厂商:UCB Pharma S.A.(比利时)
商品名:开浦兰(英文商品名:Keppra)
国内批准上市时间:2011-08-31
公司名称:UCB Pharma S.A.(比利时)
注册证号:H20110409(规格:0.25g)
H20110410(规格:0.5g)
H20110411(规格:1.0g)
6. 国内上市及知识产权情况
原料和注射液国内均未上市,口服溶液和片剂国内均仅一家上市(进口)。
左乙拉西坦是比利时UCB(优比时)公司开发研制的一种新型抗癫痫药,于1999年在美国首先上市片剂,最初用于成人部分性癫痈发作;2003年7月批准其溶液剂上市;2006年7月批准其注射液上市;2008年9月批准其缓释片上市,商品名为Keppra。主要用于治疗局限性及继发性全身性癫痫。目前在全球超过66个国家和地区上市,全球有超过100万人的治疗记录,是目前美国癫痫治疗中应用最多的新型抗癫痫药物。2007年10月正式在中国上市,商品名称为开浦兰。 左乙拉西坦2002年12月24日获得药品行政保护,于2010年6月行保结束。左乙拉西坦于2009年末失去美国专利保护, 2010年其在欧洲的专利到期。左乙拉西坦缓释剂在美国的专利于2011年末到期。经查询,本品不存在申报限制。 |

