|
仿制药研发中的几个关键问题
仿制药(又称Generic Drug)是指与原研药(或称商品名药)在剂量、安全性和效力(strength)、质量、作用(performance)以及适应症(intended use)上相同的一种仿制品,又称通用名药、非专利药等。仿制研发的目标是实现临床应用上仿制药与原研药的“可替代性”。按照美国FDA的观点,能够获得批准的仿制药必须满足以下条件:和被仿制产品含有相同的活性成分,其中非活性成分可以不同;和被仿制产品的适应症、剂型、规格、给药途径一致;生物等效;质量符合相同的要求;生产的GMP标准和被仿制产品同样严格。
仿制药的上市,可以提供更加充足的临床供应,较大幅度地降低药价,缓解患者的经济负担,具有降低医疗支出、提高药品可及性、提升医疗服务水平等重要经济和社会效益。国外统计数据显示,随着仿制药上市数量的增加,药品价格最低将下降到原研药最初价格的9%左右。
尽管如此,仿制药与原研药的差异也须引起应有的关注并着力进行有效地控制。仿制药只是复制了原研药主要成份的分子结构,而原研药生产中关键工艺步骤、关键试剂、生产工艺的“设计空间”或关键辅料的质量控制等属于企业核心机密内容,是仿制企业难以合法拷贝的,导致仿制药的杂质谱、释药行为等关键质量属性,在有些情况下难以与原研药完全一致;同时,相关法规也未规定仿制药中其他成份(辅料)的添加与原研药必须相同;在仿制药许可中,其生物利用度应具有原研药的±20%左右等。这些因素导致仿制药的安全性有效性与原研药间的差异难以完全消除。美国家庭医师学会曾在研究报告中用事实来表明原研药的疗效和安全性并不是仿制药可以完全可替代的,尤其是在治疗危急患者和危急疾病时更是需要高度关注。事实上,如何保持仿制药与原研药的“一致”,如何研究求证仿制药与原研药的“差异”,如何准确评估并有效控制这些“差异”带来的风险,正是仿制药研发中需要高度关注的重点。
1、仿制研发的基本思路与策略
1.1设计并确保与原研药的“一致性”是仿制药研发的基本思路
仿制药是对已上市原研药的“仿制”,自1983年FDA通过的Waxman法案后,各国对于仿制药,不要求重复进行原研药批准之前进行的动物研究和人体临床研究,而是通过证明和原研药的生物等效性即可获得批准,实现与原研药的临床可替代。因此,仿制研发需要围绕如下几个关键问题进行研究和求证:拟仿产品的质量概况,尤其关键质量属性(Critical Quality Attributes,CQAs)包括哪些?仿制药与原研药关键质量属性是否一致?决定产品关键质量属性的关键工艺要素包括哪些?如何从关键的工艺要素和质量标准的关键质控项目确保与原研药关键质量属性的一致性?如何在产品贮藏过程中保持这种一致?建立的质量保障体系能否有效保障研制产品与上市原研药的一致性?
但是,仿制药与原研药的“一致性”并不仅仅是指产品检验结果的一致性。药品的质量不是检验出来的,而是通过科学的设计得以保障和实现的。药品质量首先来源于早期产品及工艺的设计,形成于药品的生产过程,研发早期的产品和工艺的设计情况即决定了产品的“先天”质量特征,通过具体的生产过程将实际质量状况赋予具体产品中,质量标准用于进一步论证、揭示产品的质量,是质量保证体系的重要组成部分,但不是唯一的;药品质量的保证还要靠遵循GMP、生产工艺、原材料和生产过程的控制、稳定性研究等;药品的质量需要质量标准的终点控制和生产过程控制相结合。同时,通过研究揭示药品在各种环境因素(如温度、湿度和光等条件)影响下,其质量随时间的变化情况,并由此确立有效期以及贮藏条件,以确保其质量。
ICH在Q8、Q9中引入了质量源于设计、质量风险管理和药品质量体系的概念,指出药品的质量不是检验赋予,而是来源于设计,并利用药品研发过程中所获得的信息,在生产过程中进行质量风险管理所获得。在综合国际标准化组织(ISO)质量概念的基础上,结合生产质量管理规范(GMP),在ICH Q10提出了药品质量体系概念,认为药品质量控制应涵盖药品从研发、技术转移、商业化生产、直至药品终止的整个生命周期。从而在药品的整个生命周期内,理解和认识药品不同阶段的差异、联系以及不同的目标,在基于科学和风险的方法之上,促进创新和持续改进,保障整个生命周期的药品质量。仿制药与原研药的“一致性”需要上述各个环节的求证和保障。
1.2质量源于设计(Quality by Design,QbD)理念是仿制药研发的有效工具
与传统的质量管理模式不同,质量源于设计(QbD)理念要求在对产品质量概况(Quality Target Product Profile ,QTPP)以及关键质量属性(CQAs)充分理解的基础上,对于关键工艺参数及其与CQAs间的关联以及潜在的高风险变量进行充分研究和筛选,并建立设计空间(Design Space, DS),即影响产品CQAs的关键工艺参数范围组合,以此加强对制药过程的理解和控制,确保产品质量的持续控制。因此,从某种程度上讲,QbD是一个有效的、目标明确的药物研发工具,QbD下的药物研发是基于“质量可以设计到产品中”理念的、动态的、系统的研发过程。QbD管理模式和质控理念在仿制药研发中发挥着越来越重要的作用,在ICH及FDA近年发布的相关技术要求和指南中多已贯彻了QbD理念,FDA仿制药办公室(OGD)在2013年初即要求ANDA按照QbD相关要求提交申报资料。
QbD是一种系统的药物研发理念,其基本逻辑路径是从预先确定的目标出发,基于科学和质量风险管理,把研究重点放在对产品和生产工艺的理解、设计和控制策略上,明确关键物料属性、关键工艺参数以及潜在的高风险变量,理解工艺变异的主要来源并加以控制。将质量风险管理结合到对药品和工艺的深刻理解中,促进工艺的评估、控制和改进,以持续保证产品质量及其与原研药的一致性。对于仿制药研发而言,QbD的基本逻辑路径可如下所示:
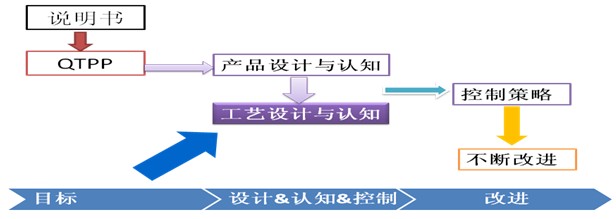
图1、QbD基本逻辑路径
2、工艺设计与研究中的QbD理念
2.1 QbD是基于风险的全面主动的药物研发理念
工艺研究的主要目的是获得符合目标产品质量属性要求的产品,建立一个能够持续稳定生产出符合预期质量要求的商业化生产工艺。通过研究评估产品的关键质量属性(CQAs),确定CQAs与关键物料属性、关键工艺步骤、关键工艺参数之间的关系,评估产品工艺特征并制定相应的控制策略,形成完整有效的过程控制措施和质量保障体系,建立并维持产品的受控状态,并促进产品质量的持续改进。根据FDA的观点,QbD是cGMP的基本组成部分,是科学的、基于风险的全面主动的药物研发方法,从产品概念到工业化生产均科学设计,是对产品属性、生产工艺与产品质量特性之间关系的透彻理解。FDA在2011版工艺验证指南中,进一步加强了QbD的管理理念,把QbD理念贯穿于工艺设计、工艺确认、持续的工艺确认等各个环节。仿制研发的目标是研究设计出与上市产品具有临床可替代的仿制药及其系统有效的药品质量保障体系。因此,仿制药工艺研究需要在对产品质量概况(QTPP)以及关键质量属性(CQAs)具有深刻理解的基础上,确认产品的关键质量属性(CQAs),设计产品和工艺以符合CQAs,通过风险评估,了解物料属性和工艺参数是如何对CQAs起影响作用,以降低风险为目标,确立设计空间,确认和控制对产品/工艺产生变异的根源,设定控制空间;通过不断地监控和升级工艺以持续确保产品质量的一致性。
传统的处方工艺研发方法是在经验基础上经过简单试验(或试错)来确定最初的处方和工艺,以使产品达到质量标准的各项要求。这种研发理念高度依赖研发人员个人的经验及偏好,处方和工艺的优化和放大高度依赖临床试验样品批次的生产经验,而这些临床样品批次的生产一般都是在固定的处方工艺参数的情况下进行的。因此,传统研发方法也是一个“解决问题”的过程,研发工作集中在解决研制及生产过程中出现并观察到的问题,对尚未观察到的潜在问题则基本未予研究。应当承认,传统的处方工艺研发方法有很长的历史并往往也是有效的,尤其是原料药具有良好的物理化学及药动学性质、制剂的载药量适当、产品适于采用普通的制剂和工艺等情况下,传统的研发思路也是行之有效的。但由于研制过程中生产的批次有限,观察到的问题往往不能涵盖长期商业生产中可能出现的问题,因而传统研发方法缺乏系统性和全面性。
一般情况下,已观察到的风险是较高的风险,但不一定是全部的风险。传统的研发思路集中精力于已观察到的风险上,虽然也是一个“基于风险评估”的思路,而且是在处理较高的风险,但不是一个全面、系统的风险控制方法,因为它基本上没有系统分析可能存在的潜在风险,没有考虑到那些尚未被观察到的风险,由于研发中产品生产的批次有限,部分风险很可能因未被观察到而未被考虑,但有可能在未来出现,特别是在比较复杂的产品上,在工艺放大和验证中,以及在长期的商业化生产中更易发生。
应当说,传统的研发方法与QbD理念并不对立:前者是后者一个不完整的部分;QbD建立在传统研发方法的基础上;QbD中的大多数元素都已经存在于传统研发方法中。与传统研发方法相比, QbD更强调有意识地系统地使用相关要素,而不一定是多做试验。例如:在研发初始即须建立书面的产品目标质量要求;在研发诸阶段须进行质量风险评估并备案;将研发中确定的关键工艺参数与关键物料特性列出并制定控制方案;将怎样实现产品各质量特性的手段系统地列入全面质量控制方案等等。
2.2 QbD在制剂工艺研究中包含的基本要素
在QbD理念中,将质量控制的重点前置于研发阶段,较传统的研发理念更加主动、系统、有效,更利于药品质量的持续改进,在对产品及其工艺全面理解基础上,采用风险控制工具识别影响产品CQAs的原材料属性和关键工艺参数、变异来源及控制措施,并依据风险评估结果建立控制策略,确立“设计空间”,设定“控制空间”,以保证产品的质量恒定。因此,QbD在制剂工艺研究中的基本要素一般应包含如下内容。
2.2.1目标产品的质量要求
首先定义目标产品的质量概况,可通过原研药说明书、质量标准、文献信息,查询临床给药特点、给药途径、剂型、规格、容器特征等信息,必要时对原研药进行分析“解剖”以获取相关信息,进行前瞻性总结,定义QTPP。在此基础上识别产品关键质量属性,制剂CQAs是指药品的物理、化学、生物或微生物性质或特征,应在适当的限度、范围或分布之内,以确保预期的产品质量。QbD下的CQAs应基于临床效果而不仅仅是工艺情况,如溶解性差的BCSⅡ和Ⅳ类药品溶出度方法和限度应能反映其临床效果,而不是单纯用于评估生产工艺的一致性;杂质可接受限度应根据临床用药的安全性要求或毒性阈值确定,而不仅仅是规模产品的批检验数据。
2.2.2质量风险评估
根据剂型特点、风险等级、原料药性质等情况,以及同类产品研发和生产的经验等来确定研究重点质量风险的内含。如注射剂相对于口服和外用制剂来讲,因直接进入血液循环或直接接触人体组织,为风险程度最高的剂型,无菌保障、热原、管道滤器等引入的外源性杂质及稳定性和复溶性应是重点考虑的质量风险来源。
2.2.3设计实验(Design of Experiments ,DoE)
合理采用系统的、有条理的数理统计方法用于研究确定影响一个过程及其结果的多因素间的关系或相互作用。具体可包括析因设计(Factorial)、Taguchi 法(Plackett-Burman设计)、响应面法(多元二次回归方程拟合)、正交设计、混合设计等产品研发常见的多因素实验设计方法。在对产品和工艺的深入研究和深入理解基础上,通过研究工艺参数与CQAs之间的相互关系,确定关键工艺步骤及关键工艺参数的变化范围,为确立“设计空间”提供科学数据。
2.2.4关键工艺参数(Critical Process Parameters,CPP)与关键物料特性(Critical Material Attributes,CMA):
在上述实验的基础上,确定原辅料性质,使用风险评估的手段和科学知识鉴定潜在的高风险因素,通过设计试验、合理使用DOE,确定高风险因素的水平和范围,将对产品质量有影响的因素定为关键性因素和关键物料特性,将经评估有可能影响产品质量或工艺有效性的工艺参数定为关键工艺参数。如替加环素含酚羟基,对光不稳定,水溶液易氧化,在中性及偏碱性溶液中更易氧化破坏,酸性溶液可相对抑制氧化,但会更易差向异构化,而乳糖等辅料可以抑制其差向异构化,因此,替加环素冻干粉针剂的生产中,原料药颜色、pH值、有关物质等以及溶剂水的温度、pH值、含氧量等为关键物料属性,乳糖为关键辅料,水溶液颜色、pH值、含氧量、温度、配制量、存放时间等为关键工艺参数。
2.2.5设计空间
采用风险控制工具识别影响产品CQAs的物料属性、关键工艺步骤及参数、变异来源及控制措施,通过研究,求证CQAs和工艺参数的关联性,确定关键生产工艺参数的可能及运行的变动范围。通过工艺的稳健性研究,评估工艺能力,是否能可靠生产出符合预期质量要求的产品,将试验研究中确定的多因素操作区间定为设计区间,使关键物料属性和工艺参数置于“设计空间”内,保证生产出的产品质量优良且恒定,在设计空间内的变动将不需要进行变更申请。
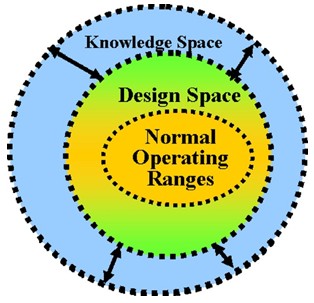
图2、设计空间(DS)示意图
2.2.6全面质量控制方案(Control Strategy,CS)
依据QbD理念,运用科学管理和质量风险管理两大核心工具建立有效的药品质量系统,该系统的目标是获得符合目标产品质量属性要求的产品、建立并维持产品的受控状态以及促进产品质量的持续改进。质量系统的主要要素应包括:工艺性能和产品质量的监控系统、校正和预防措施系统、变更管理系统以及工艺性能和产品质量的管理回顾。在产品的整个生命周期-研发、技术转移、商业化生产和产品停产等各个阶段均需贯彻实施上述要素。
按照QbD理念,产品检验符合放行标准规定并不是唯一的判定依据,需要综合考察其整个生产过程是否符合位于确立的“设计空间”,如果实际工艺参数范围超出“设计空间”,即使样品检测结果符合标准要求,该批产品亦应不予放行。
2.3杂质谱评估和分析是API工艺研究中的重要内容
QbD理念贯穿于原料药的整个研发过程,杂质是API的关键质量属性之一,尤其要结合控制策略确定对产品质量有显著影响的杂质:高风险杂质、降解物质、难以去除的杂质、难以控制的杂质等。根据具体工艺的合成机理、起始物料及各中间体基本结构,初步勾画出产品的杂质谱,根据杂质安全性风险高低、杂质出现的难易和频率以及杂质去除的难易情况,确定杂质控制的优先级别,并确定杂质控制的策略、步骤和程序。
2.3.1杂质来源分析是杂质控制策略制定的基础
杂质谱评估与分析在工艺研究中包括杂质来源分析与杂质控制策略、质量控制标准(包括原料、中间体、成品)、关键工艺步骤和工艺参数的识别与控制、反应终点判断等。总体的杂质控制策略是在杂质来源和去向分析基础上提出物料及中间体的质控内容与限度、关键工艺参数控制范围等,杂质来源和去向的分析包括工艺流程图中注明各单元操作中产生的杂质及其去向,列表说明各重点监控杂质、类别、来源、杂质去向及监控情况,这些都是工艺研究的重要内容。
起始原料的选择是工艺优化的起点,根据起始原料的合成路线以及产品特性,确定起始原料的杂质情况,根据起始原料中杂质对下一步反应的影响确定起始原料的关键质量属性,使用不同杂质含量的起始原料进行平行实验,考验工艺的耐受性并根据相应的结果以及供应商的质量情况确定起始原料的杂质指标。例如某API研发中发现成品中有杂质Q含量0.27%,超过指导原则单个未知杂质限度0.10%的规定,多种纯化措施难以降低其含量。研究推断该杂质结构后,分析其来源为起始原料中的杂质X经后续反应得到的溴代物,理论分析及相应的试验表明后续工序难以去除该杂质,取杂质X不同含量的起始物料进行工艺耐受性试验,表明若要得到杂质Q合格的成品,起始物料中的杂质X必须控制在0.07%以内,据此确立了起始物料杂质控制标准。
2.3.2杂质去向分析与控制是杂质整体控制策略的重要内容
基于杂质来源分析勾画出产品的初步杂质谱,根据相关杂质去向分析及必要的试验数据,确定整体的杂质控制策略,包括关键工艺步骤及工艺参数确立的设计空间,原料、中间体、成品的质控标准,各步反应终点的判断与控制等。如下示例,简明说明了某API产品杂质去向分析与控制的基本概况。
表1、杂质去向分析及控制策略表
|
杂质名称 |
杂质类别 |
杂质来源 |
杂质去向及监控情况 |
|
|
杂质A |
有机杂质
(去氟化合物) |
副产物 |
1、该杂质在工艺中最后转化为去氟化合物;
2、该杂质在异丙醇中有较好的溶解性,异丙醇精制中可去除,此杂质在丙酮精制中可去除;
3、CPA中间体中去氟结构杂质按限度0.1%日常监控;
4、该杂质在下一工艺会发生反应,其产物按0.3%限度日常监控,粗品中对相应结构的去氟杂质按限度0.3%日常监控和成品中对此杂质按0.3%日常监控 |
|
|
|
|
|
甲基磺酸酯 |
潜在基因毒性杂质 |
副产物 |
1、TLC点板判断反应进行情况;
2、该杂质易水解,在水洗和氢氧化钠洗涤可去除;
3、中间体1中按“甲基磺酸酯≤30ppm”日常监控。 | <, ;, TD style="PADDING-BOTTOM: 0cm; PADDING-LEFT: 5.4pt; WIDTH: 0.3pt; PADDING-RIGHT: 5.4pt; HEIGHT: 15.6pt; PADDING-TOP: 0cm" width=0>
|
|
|
甲基磺酸 |
有机杂质 |
副产物 |
该杂质溶于水,水洗可去除。 |
|
|
杂质B |
有机杂质 |
起始原料 |
杂质B易和氢氧化钠成钠盐,钠盐易溶于水,水洗可去除。 |
|
|
杂质C |
有机杂质 |
水解降解、副产物 |
1、控制中间体2水解物≤0.5%;
2、控制中间体3水解物≤0.2%;
3、成品中可控制为≤0.30% |
|
|
|
|
杂质D |
有机杂质(环己基杂质) |
副产物 |
1、中间体2控制环己基氢化物≤1.0%;
2、中间体3控制环己基氢化物≤0.5%;
3、成品中可控制为≤0.30% |
|
|
|
|
异丙醇 |
残留溶剂 |
精制溶剂 |
1、烘干去除;
2、中间体1中按干失0.5%日常监测,成品按照2000ppm控制 |
|
|
|
三乙胺 |
残留溶剂 |
反应碱化剂 |
以三乙胺盐酸盐和三乙胺形式溶于水去除 |
|
3、仿制药杂质研究与控制的思路与策略
“杂质谱”概念的提出使得药品杂质控制从最初的控制产品纯度的“间接控制杂质”阶段,上升到控制“有关物质”等的“直接控制杂质”阶段的第一次飞跃之后,实现了由有限杂质的“个别控制”阶段到杂质谱的“系统控制”阶段的第二次飞跃,从而引发了杂质研究与控制领域的深刻变化。
3.1杂质研究与控制的基本思路
杂质谱分析的思路与策略实际上是QbD理念在杂质研究中的具体实践。杂质谱被认为包括药物中各种潜在杂质的种类、来源、含量、结构及活性等的信息总和。杂质谱概念的引入进一步厘清了药品杂质研究与控制的基本思路,由传统的“以终为始”的被动思维上升到“以源为始”的主动控制模式,即不是仅仅局限于从得到的分析结果-色谱图开始分析产品杂质情况,而是从杂质来源的分析入手,结合产品的实际生产工艺、结构特点等分析可能存在于产品中的中间体、副产物、降解物、反应物料等各种潜在杂质,通过杂质谱分析全面掌握产品的杂质概貌,根据各类潜在杂质的风险级别,有针对性地建立合适的分析方法,以确保各种潜在杂质的有效检出和确认;跟踪杂质谱对安全性试验或临床试验结果产生的影响,并结合相关指导原则、文献信息等评估杂质的可接受水平,确立上市产品的杂质控制限度;同时,通过杂质谱分析明确可能的杂质来源和去向,在制备工艺设置相应杂质的针对性控制措施,并通过产品包装和贮藏条件的研究,有效抑制药品的降解,实现从杂质产生的源头主动性地把控药品杂质。
3.2杂质谱分析的基本切入点
杂质谱分析的基本思路是“以源为始”,以杂质来源为切入点,根据原料药的具体合成工艺,依据有机化学原理分析可能产生的中间体、副产物、生产中的各类降解物以及可能残存于终产品中的物料和反应试剂;根据原料药的化学结构特点,分析可能的降解途径和降解物,辅以适当的强力降解试验予以验证;根据制剂处方组成、制剂工艺特点、原辅料结构特点,分析制剂过程可能产生的降解物以及与辅料的生成物;中国药典、ICH成员国药典等收载的同品种标准控制的杂质作为基本杂质。通过以上思路全面掌握产品杂质概貌,作为杂质研究与分析方法建立与验证的基础,确保相关杂质尤其高风险杂质的有效监控。
与原研药进行杂质谱的对比分析是仿制药杂质谱分析的重要内容之一,在相应杂质物质一致性的求证中,分析手段不能等同于日常检测,分离技术(如HPLC法)与光谱分析(质谱或二极管阵列检测)相结合或使用分析标识物(如杂质对照品)、多种洗脱条件下的相对保留时间的比较等手段,以便从色谱行为、UV特征、分子量及分子碎片特征等信息共同把握其物质一致性。以列表的形式对样品与原研品进行所有杂质种类、含量及分布的比较和分析,甄别哪些杂质为原研药中不存在的新增杂质,哪些为超过原研药及指导原则规定的超量杂质,并参照杂质研究相关技术指导原则的思路,重点研究论证新增杂质及超量杂质的可接受性。
3.3根据风险级别及杂质类型制定相应的杂质分析与控制策略
根据掌握的杂质谱概况,依据各类潜在杂质的风险级别、产生的可能性高低制定进一步的研究控制策略。其中遗传毒性杂质在很低浓度时即可造成人体遗传物质的损伤,进而导致基因突变并可能促使肿瘤的发生。各发达国家和组织均严格控制此类杂质,如EMA的Guideline on the Limits of Genotoxic Impurities和Questions and Answers on the CHMP Guideline on the limits of genotoxic impurities,FDA的Guidance for Industry: Genotoxic and Carcinogenic Impurities in Drug Substances and Products: Recommended Approaches(Draft),以及ICH M7 Draft consensus guideline assessment and control of DNA reactive(Mutagenic) impurities in pharmaceuticals to limit potential carcinogenic risk等技术指导文件提供了遗传毒性杂质鉴别、分类、定量分析和控制的基本思路和策略。研发中需要根据有机化学反应机理分析原料药合成、纯化、制剂生产和贮存过程中很有可能产生的实际的和潜在的遗传毒性杂质,依据相关毒性物质数据库甄别、评估可能具有基因毒性的杂质或具有基因毒性结构单元的杂质,参照上述技术文件的研究思路与策略,对此类杂质进行针对性的确认和检出。目前国内相关数据库尚不健全的情况下,参照如下常见遗传毒性杂质结构信息进行相应的关注和研究具有一定意义:
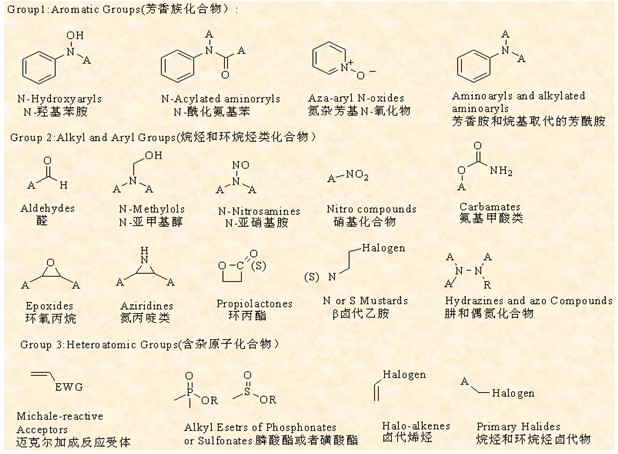
图4 具有遗传毒性化合物警惕结构单元
A为烷烃基、芳香基或H;X为卤素,包括F、Cl、Br、I;EGW为吸电子取代基,如氰基、羰基或酯基等
, 3.4标准控制杂质的基本思路
3.4.1杂质控制要体现系统性与针对性
原则上,仿制药的标准应采用国内外药典、国家标准中最严格的标准,杂质的控制一般包括每个明确的已知杂质、每个明确的未知特定杂质、任何非特定杂质(不超过鉴定限度)以及总杂质,关注是否进行了高毒性杂质与一般毒性杂质、毒性杂质与一般杂质、新增杂质与超量杂质、特定杂质与非特定杂质、单个杂质与总杂质的研究与控制。
试验表明现有技术的确无法鉴定某个杂质时,至少要提供此杂质结构的充分证据来表明它可归属为母体化合物或某侧链等有关物质,将其作为明确的未知杂质使用适当的分析标识手段进行识别和控制。
如采用HPLC法的相对保留时间识别某特定未知杂质,需要进行充分的方法耐用性的验证,并在质量标准中增加色谱柱品牌、长短、内径、填料的粒径,柱温等信息,规定难分离物质对的临界分离度要求、主成分和特定杂质的保留时间等信息,以保证品种上市后检验方法的可行性,仅仅按照中国药典标准格式规定色谱填料的类型是不够的。
3.4.2杂质限度要确保产品安全性
杂质限度的确定中应分析、评估杂质限度的合理性/安全依据,根据各特定杂质限度是否符合国内外药典/同品种国家标准限度中较严格的标准限度。一般来讲,中国药典、国家标准、ICH成员国药典同品种标准中控制的结构已知特定杂质、结构未知的特定杂质(如仅以RRT指定的杂质)要参照前述标准中的严格要求进行控制;与原研药相同的非特定杂质,需按前述标准中任一单个杂质的严格限度进行控制;如出现与原研药不同的杂质,在结合工艺等信息排除为遗传毒性杂质或其它高毒性杂质的情况下,按照杂质研究技术指导原则要求进行安全性求证或鉴定限度进行控制,并采用RRT或其它方式指认,作为特定杂质进行控制;总杂质参考前述标准的严格要求进行控制;遗传毒性杂质信息数据库有待进一步积累,除目前少数已知结构杂质外如烷化剂、黄曲霉等,其他遗传毒性杂质参考EMA、ICH等相关技术指导原则的基本思路,一般限度不超过1.5μg/天,或1ppm;研发中需高度关注国内外药典、标准中严格要求控制限度(如ppm级别)的已知杂质。
随着人们对药物研发和药品质量管理与控制科学规律的进一步认识,质量源于设计理念、质量风险管理工具两大核心策略在仿制药目标产品的生产、建立并维持产品的受控状态并促进产品质量的持续改进方面将发挥越来越重要的作用。与质量源于检验、质量源于生产、质量源于管理等理念相比,质量源于设计理念涉及领域更广泛,内涵更丰富,研发理念更加主动、系统、有效,更利于药品质量的持续改进,这无疑将对仿制药的研发带来深刻的影响,在进一步促进仿制药与原研药的“一致性”和“临床替代性”,进而有效保障患者利益方面具有积极意义。
参考文献
[1] ICH Q8 Pharmaceutical development.
[2] ICH Q9 quality risk development.
[3]ICH Q10 Pharmaceutical quality system.
[4] FDA.Quality by Design for ANDAs: An Example for Modified Release Dosage Forms[R].2011.12.
[5] FDA.Quality by Design for ANDAs: An Example for Immediate- Release Dosage Forms[R].2012.4.
[6] EMA. Guideline on the use of Near Infrared Spectroscopy(NIRS) by the pharmaceutical industry and the data requirements for new submissions and variations. 2012.
[7] 张哲峰, 新法规下药物研发中的几个关键问题。 中国药事,2010,9:840-844。
[8] 张哲峰, 我国药物研发中杂质研究面临的挑战与思考。药品评价,2010,18(7):12-19
(来自:CDE)
|




